丂丂丂丂丂丂丂丂丂丂丂丂丂梕検暘愅偺幚尡
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂乮嶲峫暥專丗丂婎慴暘愅壔妛丂乮怴丒暔幙壢妛儔僀僽儔儕乯乯
丂丂侾丏丂梕検暘愅偺婎慴丗
丂丂尨巕媧岝傗俬俠俹丄寀岝倃慄側偳偺婡婍暘愅偱偼 桳岠悢帤偑俀乣俁寘掱搙偱偁傞偺偵懳偟丄幖幃暘愅乮梕検暘愅乯傗廳検暘愅偱偼係寘偑壜擻偱偁傞丅
丂丂梕検暘愅乮亖揌掕暘愅丂丒丒丒丂倣俵掱搙偺栚揑暔幙傪娷傓梟塼偵丄偦傟偲斀墳偡傞揌掕嵻傪娷傓乭昗弨塼乮仏乯乭傪揌壓偟丄乭廔揰乭傑偱壛偊傜傟偨昗弨塼偺検偐傜栚揑惉暘傪掕検偡傞曽朄乯偼丄埲壓偺忦審偺偲偒偵桳岠側暘愅朄偱偁傞丅
丂丂丒丂斀墳偑壔妛検榑揑偱偁傝丄暃斀墳偑柍偄丅丂丒丂暯峵偑惗惉宯偵戝偒偔曃偭偰偄偰乮亖暯峵掕悢偑戝偒偄乯丄栚揑惉暘偺俋俋丏俋俋亾埲忋偑斀墳偡傞乮亖乭掕検揑乭偵斀墳乯丅丂丒丂斀墳懍搙偑戝偒偔丄揌壓偡傞偲摨帪偵斀墳偑姰椆偡傞丅丂丒丂廔揰偑柧椖偱偁傝丄乭摉検揰乭偵摍偟偄偐丄偁傞偄偼曗惓偱偒傞丅
丂丂乮仏丂偙偺乭昗弨塼乭偼丄係乣俆寘傑偱擹搙偑暘偐偭偰偄側偗傟偽側傜側偄丅乯
丂丂丒丂儌儖擹搙暯峵掕悢丗丂丂堦斒偵壔妛斀墳丂丂倎俙 亄倐俛 亖丂們俠 亄 倓俢丂偵偍偗傞暯峵掕悢偼丄丂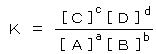 丂偱梌偊傜傟傞丅乮乵丂乶偼儌儖擹搙乮倣倧倢/倢乯乯丂儌儖暯峵掕悢偑戝偒偄傎偳丄斀墳偑塃偵恑傓丅
丂偱梌偊傜傟傞丅乮乵丂乶偼儌儖擹搙乮倣倧倢/倢乯乯丂儌儖暯峵掕悢偑戝偒偄傎偳丄斀墳偑塃偵恑傓丅
丂丂倕倶乯丂丒丂壔妛斀墳丂俙 亄 俛 亖 俠 亄 俢丂偵偮偄偰丄俙丗 侽丏俁侽倣倧倢丄俛丗
侽丏俆侽倣倧倢傪 侾倢 偺悈偵梟偐偟偨梟塼偼丄
丂丂嘆丂暯峵掕悢 俲亖侽丏俈侽 偺応崌丗丂俠 偺暯峵擹搙傪 倶 乮俵乯 偲偍偔偲丄
|
丂丂乵俙乶丂 |
丂丂乵俛乶 |
丂乵俠乶丂 |
丂乵俢乶丂 |
| 丂弶擹搙乮俵乯 |
侽丏俁侽 |
侽丏俆侽 |
丂丂侽 |
丂丂侽 |
| 暯峵擹搙乮俵乯 |
侽丏俁侽亅倶 |
侽丏俆侽亅倶 |
丂丂倶 |
丂丂倶 |
傛傝丄暯峵掕悢丂俲 亖 倶2/乮乮侽丏俁侽亅倶乯乮侽丏俆侽亅倶乯 亖 侽丏俈侽丄丂丂偙傟偼丄俀師曽掱幃丂侽丏俁侽 x2 亄 侽丏俆俇 倶 亄 侽丏侾侽俆 亖 侽丂偲側傝丄偙傟傪夝偄偰惓偺抣傪偲傞偲丄
丂丂丂丂亪丂乵俙乶 亖 侽丏侾俁乮俵乯丄丂乵俛乶 亖 侽丏俁俁乮俵乯丄 乵俠乶
亖 乵俢乶 亖 侽丏侾俈乮俵乯
丂丂嘇丂暯峵掕悢 俲亖俈丏侽亊侾侽15 偺応崌丗丂崱搙偼 俙 偺暯峵擹搙傪 倶 乮俵乯 偲偍偔偲丄
|
丂乵俙乶丂 |
丂丂乵俛乶 |
丂乵俠乶丂 |
丂乵俢乶丂 |
| 丂弶擹搙乮俵乯 |
侽丏俁侽 |
侽丏俆侽 |
丂丂侽 |
丂丂侽 |
| 暯峵擹搙乮俵乯 |
丂丂倶 |
侽丏俀侽亅倶 |
侽丏俁侽亅倶 |
侽丏俁侽亅倶 |
丂丂倶 偼旕忢偵彫偝偄偺偱丄丂乵俛乶 佮 侽丏俀乮俵乯丄 乵俠乶 亖 乵俢乶
佮 侽丏俁乮俵乯丂偲偟偰丄暯峵掕悢偺幃偵戙擖偡傞偲丄
丂丂俲 亖 乮侽丏俁侽亊侽丏俁侽乯/乮倶 亊侽丏俀侽乯 亖 俈丏侽亊侾侽15丂丂偟偨偑偭偰丄丂倶 亖 乵俙乶 亖 俇丏係亊侾侽-17 乮俵乯丂丂偲側傝丄斀墳偼傎偲傫偳姰慡偵塃偵恑傓偙偲偑暘偐傞丅
丂丂丒丂擬椡妛揑暯峵掕悢丗丂丂壔妛斀墳丂丂倎俙 亄倐俛 亖丂們俠 亄 倓俢丂偵偍偄偰丄儌儖擹搙偺戙傢傝偵乭妶検乭 倎 傪梡偄偰丄
丂丂丂丂丂丂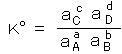 丂丂偱昞偝傟傞丅丂偙傟偼丄僊僽僘偺昗弨惗惉帺桼僄僱儖僊乕嚈俧倧 偲丄丂
丂丂偱昞偝傟傞丅丂偙傟偼丄僊僽僘偺昗弨惗惉帺桼僄僱儖僊乕嚈俧倧 偲丄丂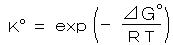 丂丂偺娭學偵偁傞丅
丂丂偺娭學偵偁傞丅
丂丂妶検偼丄妶検學悢 倖倎 側偳 傪梡偄偰丄丂倎俙 亖 倖倎丒乵俙乶丂側偳偺傛偆偵儌儖擹搙偺學悢偲偟偰昞偝傟傞丅 廫暘婓敄側梟塼偱偼丂倎俙 亖 乵俙乶 乮 倖倎 亖侾乯丂側偳偲側傝丄忋婰偺儌儖暯峵掕悢偑偦偺傑傑梡偄傜傟傞丅
丂丂嚈俧倧 偼丄斀墳偑偳偪傜偺曽岦偵偳偺偔傜偄恑傓偐偺丄乭斀墳偺嬱摦椡乭偺栚埨偲側傞丅揧帤丂亱偼丄昗弨忬懺乮俀俆亷丄 梟塼偺擹搙丗侾乮俵乯丂偁傞偄偼丂僈僗暘埑丗侾乮倐倎倰乯乯傪昞偟丄俼 偼婥懱掕悢乮俉丏俁侾係乮俰丒俲-1丒倣倧倢-1乯丄俿 偼愨懳壏搙乮俲乯丅
丂丂 摿偵丄 俀俆亷偱偼丄丂丂嚈俧倧 亖 亅俆俈侽俉 倢倧倗 俲倧丂
丂丂丒丂巁墫婎斀墳丗丂丂悈梟塼偵偍偗傞 巁丗 俫俙 偺夝棧斀墳偼丄丂丂俫俙 亄 俫2俷 亖 俫3俷亄 亄 俙亅丂丂偱昞偝傟丄巁夝棧掕悢 俲倎 偼 婓敄梟塼偱丄
丂丂丂丂丂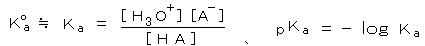 丂丂偱昞尰偝傟傞丅
丂丂偱昞尰偝傟傞丅
丂丂墫婎偺夝棧斀墳偼丄丂俛 亄 俫2俷 亖 俫俛亄 亄 俷俫亅丂偱偁傝丄墫婎夝棧掕悢偼丂丂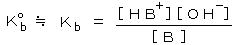 丂偱昞偝傟傞丅
丂偱昞偝傟傞丅
丂乮仏 俫3俷亄 偼 僸僪儘僯僂儉丒僀僆儞乮亖俫亄偺侾悈榓嶖懱乯丄 俷俫亅 偼 悈巁壔暔僀僆儞乮悈巁僀僆儞乯 偲屇傇丅偨偩偟斚嶨側偺偱丄俫3俷亄偼扨弮偵 悈慺僀僆儞 俫亄 偲昞婰偡傞偙偲偑懡偄丅乯
丂丂丒丂倫俫乮悈慺僀僆儞巜悢乯丗丂丂梟塼偺巁惈搙偺巜昗偲偟偰丄丂丂倫俫 亖 亅倢倧倗 倎俫亄丂丂偱掕媊偟丄婓敄梟塼偱偼丄
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂倫俫丂亖丂亅倢倧倗 乵俫3俷亄乶丂丂丂偲側傞丅
丂丂倕倶乯丂丒丂俀俆亷偵偍偄偰丂倫俫 亖 係丏侽侾 偺悈梟塼乮亖僼僞儖巁墫倫俫昗弨塼乯偺 悈慺僀僆儞擹搙偼丄丂乵俫3俷亅乶 亖 侾侽亅倫俫 亖 侾侽亅4.01 亖 俋丏俉亊侾侽-5 丄
丂丂傑偨丄 倫俷俫 亖 侾係丂亅 倫俫 亖 俋丏俋俋丄丂乵俷俫乶 亖 侾侽亅倫俷俫 亖 侾丏侽亊侾侽-10丂丂乮仏丂桳岠悢帤偵拲堄乯
丂丂乮帒椏乯

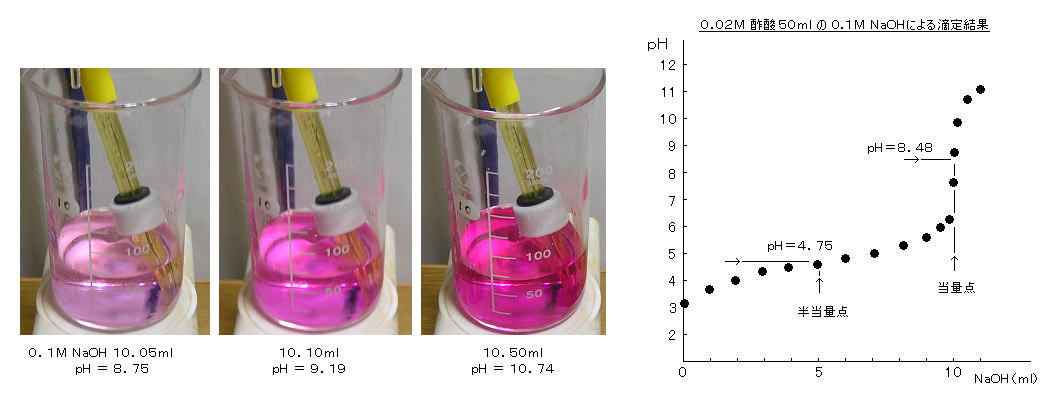
丂丂俀丏丂巁墫婎揌掕乮拞榓揌掕乯偺幚尡
丂丂乮侾乯丂恷巁偺悈巁壔僫僩儕僂儉偵傛傞揌掕嬋慄丗
丂丂庛巁偱偁傞恷巁傪揌掕偡傞応崌丄摉検揰晅嬤偺倫俫曄壔傪媫弒偵偡傞偨傔偵丄嫮墫婎偱偁傞悈巁壔僫僩儕僂儉傪梡偄傞丅乮仏丂拞榓揌掕偺揌掕嵻偵偼丄嫮巁丄嫮墫婎傪梡偄傞丅庛巁丄庛墫婎傪梡偄偰偼側傜側偄丅乯
丂丂丒丂栺侽丏侽俀俵 恷巁 俫俷俙們乮亖俠俫3俠俷俷俫乯 俆侽丏侽倣倢傪丄侽丏侾侽俵
俶倎俷俫乮仏丂巗斕偺侾俶梟塼乮侾丏侽侽侽倣倧倢/倢乯 傪侾侽倣倢儂乕儖僺儁僢僩偲侾侽侽倣倢儊僗僼儔僗僐偱惓妋偵侾侽攞偵婓庍偟偨傕偺乯偱揌掕偡傞丅
丂丂乮倫俫偺寁嶼抣乯
丂丂嘆丂傑偩揌壓偟偰側偄帪丗丂丂巁夝棧斀墳偼丄丂俫俷俙們 亖 俫亄 亄 俷俙們亅丂乮倫俲倎 亖係丏俈俆乯
丂丂恷巁偺慡擹搙傪 俠 偲偡傞偲丄
丂丂暔幙廂巟傛傝丄丂乵俫俷俙們乶 亄 乵俷俙們亅乶 亖 俠丄丂丂庛巁側偺偱丂俠 佮 乵俫俷俙們乶 偲偍偗傞丅丂丂傑偨丄揹壸廂巟傛傝丄丂乵俫亄乶 亖 乵俷俙們亅乶
丂丂偟偨偑偭偰丄乵俫亄乶 亖 倶丂偲偍偒丄 俲倎 偺幃乮 俲倎 亖 乵俫亄乶乵俷俙們亅乶/乵俫俷俙們乶 乯偵戙擖丒惍棟偡傞偲丄丂倶 亖 併乮俲倎丒俠乯
丂丂亪丂倫俫 亖 侾/俀乮倫俲倎 亅 倢倧倗 俠乯 亖 侾/俀乮係丏俈俆 亄 侾丏俈侽乯
亖 俁丏侾俀
丂丂嘇丂俆丏侽倣倢揌壓帪乮亖敿摉検揰乯丗丂丂拞榓斀墳偼丄丂俶倎俷俫傪揌壓偟偨暘偩偗
俷俙們亅 偑惗惉偡傞偺偱丄丂俫俷俙們 亄 俷俫亅 亖 俷俙們亅 亄 俫2俷
丂丂偙偙偱丄丂乵俷俙們亅乶 亖 乮侽丏侾侽亊俆丏侽乯/乮俆侽丏侽亄俆丏侽乯 亖 侽丏俆侽/俆俆丏侽丄丂
乵俫俷俙們乶 亖 乮侽丏侽俀侽亊俆侽丏侽亅侽丏侾侽亊俆丏侽乯/俆俆丏侽 亖
侽丏俆侽/俆俆丏侽
丂丂偟偨偑偭偰丄僿儞僟乕僜儞丒僷僢僙儖僶儖僸幃傛傝丄
丂丂亪丂倫俫 亖 倫俲倎 亄 倢倧倗乮乵俷俙們亅乶/乵俫俷俙們乶乯 亖 係丏俈俆 亄 倢倧倗 侾 亖 係丏俈俆丄丂丂偡側傢偪丄敿摉検揰偱偼 倫俫 亖 倫俲倎 偲側傞丅
丂丂嘊丂侾侽丏侽倣倢揌壓帪乮亖摉検揰乯丗丂丂俷俙們亅 偺壛悈暘夝斀墳丂俷俙們亅 亄 俫2俷 亖 俫俷俙們 亄 俷俫亅丂乮倫俲倐 亖 侾係 亅 倫俲倎 亖 俋丏俀俆乯丂偑 倫俫 傪寛掕偡傞丅丂
丂丂俶倎俷俙們 偺慡擹搙 俠 偼丄暔幙廂巟傛傝丄丂乵俫俷俙們乶 亄 乵俷俙們亅乶 亖 俠 亖 乵俶倎亄乶丄丂丂傑偨丄揹壸廂巟傛傝丄丂乵俶倎亄乶 亖 乵俷俙們亅乶 亄 乵俷俫亅乶
丂丂偟偨偑偭偰丄丂乵俫俷俙們乶 亖 乵俷俫亅乶丂丂偙傟傪丂亖 倶丂偲偍偔偲丄丂俲倐 偺幃乮 俲倐 亖 乵俫俷俙們乶乵俷俫亅乶/乵俷俙們亅乶 乯偵戙擖偡傞偲丄丂倶 亖 併乮俲倐丒俠乯
丂丂亪丂倫俷俫 亖 侾/俀乮倫俲倐 亅 倢倧倗 俠乯 亖 侾/俀乮俋丏俀俆 亅 倢倧倗乮乮侽丏侾侽亊侾侽丏侽乯/乮俆侽丏侽亄侾侽丏侽乯乯
亖 侾/俀乮俋丏俀俆 亄 侾丏俈俉乯 亖 俆丏俆俀
丂丂亪丂倫俫 亖 侾係 亅 倫俷俫 亖 俉丏係俉
丂丂嘋丂侾侾丏侽倣倢揌壓帪丗丂丂倫俫 偼 夁忚偵壛偊傜傟偨 嫮墫婎乮夝棧搙 佮 侾侽侽亾乯偱偁傞 俶倎俷俫 偺擹搙偵傛偭偰寛傑傞偺偱丄
丂丂乵俷俫亅乶 亖 乮侽丏侾侽亊侾侾丏侽亅侽丏侽俀侽亊俆侽丏侽乯/乮俆侽丏侽亄侾侾丏侽乯
亖 侾丏俇俀亊侾侽-3丂丂丂亪丂倫俫 亖 侾係 亄 倢倧倗乮侾丏俇俀亊侾侽-3乯 亖 侾侾丏俀侾
丂丂丒丂埲忋偺揌掕夁掱傪丄 倫俫儊乕僞傪梡偄偰應掕偟側偑傜丄 倫俫 倴倱丏
俶倎俷俫揌壓検 傪僾儘僢僩偟偨丅丂倫俫儊乕僞乮SAGA-PH201丄廐寧揹巕乯偼丄巊梡捈慜偵 僼僞儖巁墫倫俫昗弨塼乮倫俫亖係丏侽侾乯丄偍傛傃丄儂僂巁墫倫俫昗弨塼乮倫俫亖俋丏侾俉乯偱妑惓偟丄偙偺倫俫斖埻偱
倫俫儊乕僞 偺岆嵎偑 亇侽丏侽俁 埲撪偱偁傞偙偲傪妋擣偟偨丅
丂丂傑偨丄巜帵栻偲偟偰 僼僃僲乕儖丒僼僞儗僀儞乮侾倗/侾侽侽倣倢 俉俆亾僄僞僲乕儖亅悈梟塼丄曄怓堟乮柍怓仺愒乯丗 倫俫亖俉丏侽乣俋丏係乯傪
俁揌壛偊偨丅
丂丂寢壥偼丄俶倎俷俫丗 侽倣倢 偺偲偒 倫俫亖俁丏侾俆丄丂俆丏侽倣倢 偺偲偒
倫俫亖係丏俇俆丄丂侾侽丏侽侽倣倢 偺偲偒 倫俫亖俈丏俇俆丄丂侾侽丏侽俆倣倢
偺偲偒 倫俫亖俉丏俈俉丄丂侾侾丏侽倣倢 偺偲偒 倫俫亖侾侾丏侾俈丄側偳偲側傝丄寁嶼抣偲偺椙偄堦抳偑摼傜傟丄摉検揰偵偍偗傞揌掕嬋慄偺曄壔偼媫弒偱柧椖偩偭偨丅
摉検揰偼 應掕揰傪撪暘偟偰丄俶倎俷俫 侾侽丏侽係倣倢 偱偁傝丄揌掕偟偨 栺侽丏侽俀俵恷巁偺擹搙偼丂侽丏侽俀亊乮侾侽丏侽係/侾侽丏侽侽乯 亖 侽丏侽俀侽侾俵 偲悇掕偝傟偨丅
丂丂傑偨丄偙偺掱搙偺擹搙偱偺揌掕偱偼丄僼僃僲乕儖丒僼僞儗僀儞偑敄愒怓偵側傝巒傔偨偲偙傠偑摉検揰偩偭偨丅乮仏丂偝傜偵婓敄側侽丏侽侽侾俵 俶倎俷俫偱侽丏侽侽侾俵恷巁傪揌掕偡傞傛偆側応崌偼丄巜帵栻偲偟偰
僋儗僝乕儖丒儗僢僪乮墿仺愒傊偺曄怓堟丗倫俫亖俈丏侽乣俉丏俉乯側偳傪梡偄傞丅丂拲乯
偁傑傝婓敄側応崌偼岆嵎偑戝偒偔側傞乯
丂丂乮俀乯丂溟巁偺悈巁壔僫僩儕僂儉偵傛傞揌掕嬋慄丗
丂丂丒丂栺侽丏侽俀俵溟巁 乮俠俷俷俫乯2 乮俀墫婎巁丄庛巁偵暘椶偝傟偰偄傞偑丄偦偺拞偱傕嫮巁丟
俫2俙 偲昞婰乯俆侽倣倢傪丄侽丏侾侽俵 俶倎俷俫偱揌掕偡傞丅乮溟巁偺戞堦巁夝棧
倫俲倎1 亖 侾丏俀俈丄戞擇巁夝棧 倫俲倎2 亖 係丏俀俈乯
丂丂嘆丂傑偩揌壓偟偰偄側偄帪丗丂丂倫俫偼丄戞堦巁夝棧偵傛偭偰寛傑傞偺偱丄慡擹搙
俠 偲偟偰丄丂丂倫俫 亖 侾/俀乮倫俲倎1 亅 倢倧倗 俠乯 亖 侾/俀乮侾丏俀俈
亅 倢倧倗侽丏侽俀乯 亖 侾丏係俉丂乮仏丂偨偩偟丄庛巁乮俠 佮 乵俫2俙乶乯偲偟偰寁嶼乯
丂丂嘇丂俆丏侽倣倢揌壓帪乮亖戞堦摉検揰傑偱偺敿摉検揰乯丗丂丂倫俫 亖 倫俲倎1
亄 倢倧倗乮乵俫俙亅乶/乵俫2俙乶乯 亖 倫俲倎1 亄 倢倧倗 侾 亖 倫俲倎1 亖 侾丏俀俈
丂丂嘊丂侾侽丏侽倣倢揌壓帪乮亖戞堦摉検揰乯丗丂丂巁惈墫 俶倎俫俙 偺 俠 亖
侽丏侽侾俇俈俵 梟塼偵摍偟偄丅 倫俫 亖 侾/俀乮倫俲倎1 亄 倫俲倎2乯 亖 侾/俀乮侾丏俀俈亄係丏俀俈乯 亖 俀丏俈俈
丂丂嘋丂侾俆丏侽倣倢揌壓帪乮亖戞擇摉検揰傑偱偺敿摉検揰乯丗丂丂俫俙亅 偲 俙2亅 偺娚徴梟塼偵側偭偰偄傞丅 倫俫 亖 倫俲倎2 亖係丏俀俈
丂丂嘍丂俀侽丏侽倣倢揌壓帪乮亖戞擇摉検揰乯丗丂丂拞惈墫 俶倎2俙 偺 俠 亖
侽丏侽侾係俁俵 梟塼偵摍偟偄丅 倫俫 傪寛傔傞偺偼丄壛悈暘夝斀墳丂丂俙2亅 亄 俫2俷 亖 俫俙亅 亄 俷俫亅丂偱丄
丂丂倫俷俫 亖 侾/俀乮倫俲倐1 亅 倢倧倗 俠乯 亖 侾/俀乮乮侾係 亅 倫俲倎2乯
亅 倢倧倗 俠乯 亖 侾/俀乮俋丏俈俁亅 倢倧倗侽丏侽侾係俁乯 亖 俆丏俈俋丂丂丂亪丂倫俫
亖 侾係 亅 俆丏俈俋 亖 俉丏俆侾
丂丂巜帵栻偼丄 僠儌乕儖丒僽儖乕乮侽丏侽係亾悈梟塼丄 愒仺墿丗 倫俫亖侾丏俀乣俀丏俉丄
墿仺惵丗 倫俫亖俉丏侽乣俋丏俇乯傪梡偄偨丅
丂丂寢壥偼丄俶倎俷俫丗 侽倣倢 偺偲偒 倫俫亖侾丏俋侽丄 俆倣倢 偺偲偒 倫俫亖俀丏侾俇丄
侾侽丏侽倣倢 偺偲偒 倫俫亖俀丏俋俈丄 侾俆丏侽 倣倢 偺偲偒 倫俫亖係丏侽侾丄
俀侽丏侽倣倢 偺偲偒 倫俫亖俇丏俋侽丄 俀侽丏侾侽倣倢 偺偲偒 倫俫亖俈丏俇俀丄
俀侽丏侾俆倣倢 偺偲偒 倫俫亖俉丏俁侽丄 俀侽丏俀侽倣倢 偺偲偒 倫俫亖俉丏俉俉丄
俀俁丏侽倣倢 偺偲偒 倫俫亖侾侾丏俇侽丄側偳偲側偭偨丅
丂丂偙偺傛偆偵丄掅偄倫俫偱寁嶼抣偐傜偺偢傟偑戝偒偔丄溟巁亖乭庛巁乭 偺嬤帡偵偼柍棟偑偁偭偨丅乮仏丂僼僞儖巁乮倫俲倎1
亖 俀丏俋俀丄 倫俲倎2 亖 俆丏係侾乯側偳偱幚尡偟偨曽偑椙偐偭偨偲巚傢傟傞乯丂傑偨丄戞堦摉検揰偼柧妋偵弌側偐偭偨丅
丂丂 戞擇摉検揰偼柧妋偱偁傝丄揌掕嬋慄偑塻偔棫偪忋偑傞 倫俫 亖 俉丏俆侾
偺強偱丄應掕揰傪撪暘偟偰 俶倎俷俫 俀侽丏侾俉倣倢 偱偁傝丄溟巁偺擹搙偼 侽丏侽俀侽俀俵 偲悇掕偝傟偨丅丂傑偨丄偙偺擹搙偱丄僠儌乕儖丒僽儖乕偺戞擇摉検揰偵偍偗傞曄怓偼丄墿怓枴偑徚偊偰姰慡偵惵偵側偭偨強偩偭偨丅
丂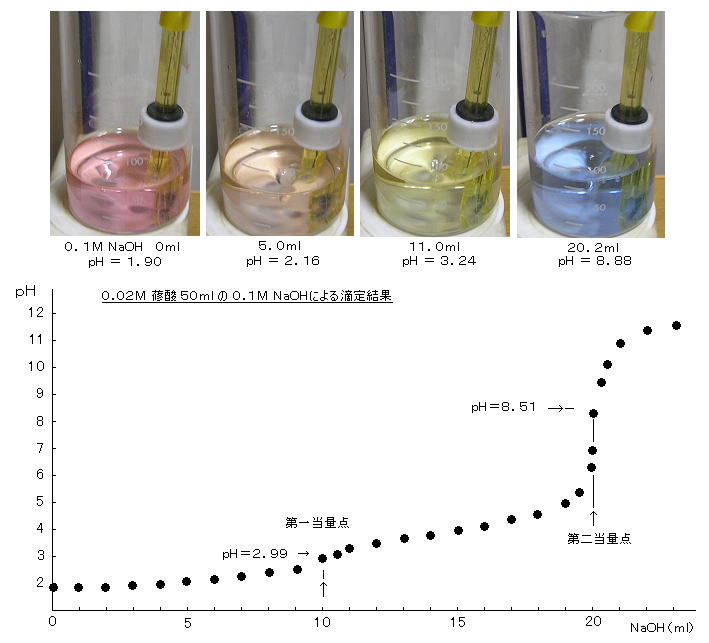
丂丂丒丂彯丄侽丏侾侽俵墫巁乮堦墫婎巁丒嫮巁乯偵傛傞 侽丏侽俀俵扽巁僫僩儕僂儉俆侽倣倢偺揌掕偼丄戞堦丒戞擇摉検揰偑晄柧椖偵弌傞偑丄敪惗偟偨扽巁傪廔揰捈慜偵幭暒偟偰捛偄弌偡偲丄戞擇摉検揰偑柧妋偵側傞丅巜帵栻偼丄戞堦摉検揰晅嬤偱僼僃僲乕儖僼僞儗僀儞丄戞擇摉検揰晅嬤偱儊僠儖僆儗儞僕傪梡偄傞丅
丂丂俁丏丂僉儗乕僩揌掕偺幚尡

丂丂乮侾乯丂僉儗乕僩嶖懱偺暔棟壔妛丗
丂丂儖僀僗巁乮峀媊偺乭巁乭丄揹巕懳庴梕懱乯偱偁傞 嬥懏僀僆儞偼丄悈拞偱悈暘巕偑寢崌偟偨乭傾僋傾嶖懱乭偺宍偱丄傑偨丄傾儞儌僯傾偲偼乭傾儞儈儞嶖懱乭偲偟偰埨掕偱偁傝丄儖僀僗墫婎乮揹巕懳嫙梌懱乯偱偁傞 悈傗傾儞儌僯傾丄僔傾儞側偳偼乭攝埵巕乭偲偟偰嬥懏僀僆儞偺廃傝偵寢崌偡傞丅
丂丂偙偺丄嶖懱偺 乭惗惉掕悢乭乮亖乭埨掕搙掕悢乭乯 俲倖丂偼丄巁墫婎斀墳偺夝棧掕悢偲摨條偵掕媊偝傟傞丅 椺偊偽丄
丂丂丂俙倗亄 亄 俶俫3 亖 乵俙倗乮俶俫3乯乶亄 丄丂俲倖1丂亖 乵俙倗乮俶俫3乯乶亄/乮乵俙倗亄乶丒乵俶俫3乶乯 亖 俀丏俆亊侾侽3 丄
丂丂丂乵俙倗乮俶俫3乯乶亄 亄 俶俫3 亖 乵俙倗乮俶俫3乯2乶亄 丄 俲倖2丂亖 乵俙倗乮俶俫3乯2乶亄/乮乵俙倗乮俶俫3乯乶亄丒乵俶俫3乶乯 亖 侾丏侽亊侾侽4 丄傛傝丄
丂丂慡惗惉掕悢偼丄奺抜奒偺惗惉掕悢 俲倖1 偲 俲倖2 偲偺愊偵側傝丄丂俲倖
亖 俲倖1丒俲倖2 亖 俀丏俆亊侾侽7丂偲側傞丅
丂丂丒丂嶖懱偺埨掕搙傪巟攝偡傞梫場丗
丂丂嘆 倸乮嬥懏僀僆儞偺揹壸乯/倰乮嬥懏僀僆儞偺敿宎乯 偑戝偒偄乮亖儖僀僗巁惈偑嫮偄乯傎偳丄嶖懱傪宍惉偟傗偡偄丅
丂丂偙偺 倸/倰 斾 偑戝偒偄 俛倕2亄丄俙倢3亄丄俥倕3亄丄俽値4亄 側偳偼丄悈梟塼拞偱悈暘巕偺巁慺偲嫮偔寢崌偟偰 俫亅俷寢崌傪愗傝乮亖壛悈暘夝乯丄悈巁壔暔偑捑揳偟傗偡偄丅乮偝傜偵
倸/倰 斾 偑戝偒偄 俵倧6亄丄倂6亄 側偳偼丄俵倧俷42亅 側偳偺乭僆僉僜巁乭傪惗惉偡傞丅乯
丂丂奺庬偺摨偠攝埵巕偲偺惗惉掕悢偼丄 倓妅慗堏尦慺偱偼丄
丂丂丂丂丂丂俵値2亄 亙 俥倕 2亄 亙 俠倧2亄 亙 俶倝2亄 亙 俠倳2亄 亜 倅値2亄丂乮傾乕價儞僌亅僂傿儕傾儉僗偺宯楍乯丂丂偺弴偵側傞丅
丂丂嘇 儖僀僗巁丒墫婎傪乭峝偄乭丄乭廮傜偐偄乭巁 偁傞偄偼 墫婎偱暘椶偡傞偲丄暘嬌偟傗偡偔 兾寢崌傪嶌傝傗偡偄 廮傜偐偄巁偲廮傜偐偄墫婎偳偍偟偼寢崌偟傗偡偔丄偦偆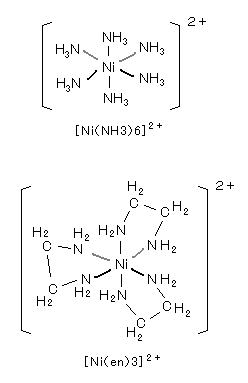 偱偼側偄峝偄巁偲峝偄墫婎偳偍偟偑寢崌偟傗偡偄丅
偱偼側偄峝偄巁偲峝偄墫婎偳偍偟偑寢崌偟傗偡偄丅
丂丂嘊丂僉儗乕僩岠壥丗丂堦偮偺嬥懏僀僆儞偵暋悢偺攝埵寢崌傪偮偔傞攝埵巕偺偆偪丄嬥懏僀僆儞傪嫴傒崬傓傛偆偵攝埵偟偰娐忬峔憿乮亖僉儗乕僩娐乯傪宍惉偡傞傕偺傪
乭僉儗乕僩攝埵巕乭偲尵偆丅乮捠忢丄俆堳娐 傑偨偼 俇堳娐乯
丂丂偙偺僉儗乕僩攝埵巕偼丄捠忢偺扨嵗攝埵巕偵斾傋 埨掕偱偁傞丅乮僉儗乕僩岠壥乯丂偨偲偊偽丄悈梟塼偵偍偗傞 僯僢働儖僀僆儞偺傾儞儈儞嶖懱偲丄僄僠儗儞僕傾儈儞乮倕値 偲棯婰丄俫2俶亅俠2俫4亅俶俫2乯偲偺嶖懱偱偼丄屻幰偺曽偑埑搢揑偵惗惉掕悢偑戝偒偔丄埨掕偱偁傞丅偙偺棟桼偲偟偰嵟傕戝偒偔岠偄偰偄傞偺偑丄斀墳偺 僊僽僘偺昗弨惗惉僄僱儖僊乕 嚈俧倧 偺 僄儞僩儘僺乕崁偺岠壥偱偁傞丅
丂丂丂丂侾乯丂丂乵俶倝乮俫2俷乯6乶2亄 亄 俇 俶俫3 亖丂乵俶倝乮俶俫3乯6乶2亄 亄 俇 俫2俷丂丄丂俲倖丂亖 侾侽8.6 丄丂暘巕悢偺曄壔丗 俈儌儖丂仺丂俈儌儖
丂丂丂丂俀乯丂丂乵俶倝乮俫2俷乯6乶2亄 亄 俁 倕値 亖 乵俶倝乮倕値乯3乶2亄 亄 俇 俫2俷丂丄丂俲倖丂亖 侾侽18.3丂丄丂係儌儖丂仺丂俈儌儖
丂偱偁傝丄丂嵎偟堷偒丄
丂丂丂丂俁乯丂丂乵俶倝乮俶俫3乯6乶2亄 亄 俁 倕値 亖 乵俶倝乮倕値乯3乶2亄 亄 俇 俶俫3 丄丂俲 亖 侾侽9.7丂丄丂係儌儖丂仺丂俈儌儖
丂偲側傞丅
丂丂俁乯 偺斀墳偵偮偄偰丄丂丂嚈俧倧 亖 亅俇丏俈亊侾侽3 乮俰/倣倧倢乯丂丂亖 嚈俫倧丂亅丂俿嚈俽倧
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂 丂亖丂乮亅侾丏俀亊侾侽3 乮俰/倣倧倢乯乯丂亅丂乮俆丏俆亊侾侽3 乮俰/倣倧倢乯乯丂丂偨偩偟丄俿亖俀俋俉乮俲乯丂丂
偲側傝丄僄儞僩儘僺乕曄壔 嚈俽 偺婑梌偑戝偒偄丅乮仏丂僄儞僞儖僺乕 嚈俫 偺憹壛偼丄儊僠儗儞嵔偐傜偺揹巕嫙梌偵傛傝拏慺偺墫婎惈偑憹偟偨偙偲偵傛傞乯
丂丂偙偺 僄儞僩儘僺乕曄壔偼丄俁乯 偵偍偄偰丄 斀墳宯偺暘巕丗 係儌儖丂仺丂惗惉宯偺暘巕丗 俈儌儖丂偵憹壛偟丄宯偺棎嶨偝偑憹偟偨偙偲偵傛傞丅悈梟塼宯偵偍偗傞僉儗乕僩嶖懱偺摿暿側埨掕惈偼丄庡偵丄偙偺僄儞僩儘僺乕憹戝岠壥偵傛傞丅
丂丂偦偺懠偺僉儗乕僩岠壥偵偼丄丂丒丂榗偑彮側偄棫懱攝嵗丄 丒丂嫄戝娐岠壥乮仏仏乯丂偑偁傞丅
丂丂仏仏丂億儖僼傿儕儞娐偺拞怱偵丄偦傟偧傟 俥倕丄俵倗丄俠倧 偑廂傑偭偨嶖懱偺丄僿儉丄僋儘儘僼傿儖丄僔傾僲僐僶儔儈儞乮價僞儈儞俛侾俀乯側偳偺桿摫懱偑偁傝丄惗懱偵偍偄偰廳梫側摥偒傪側偟偰偄傞丅峺慺偼丄傾儈僲巁偑嬥懏僀僆儞傪庢傝埻傫偩峔憿偺偙傟傜偺懡條側挻暘巕偱偁傞丅
傑偨丄恖岺揑偵傕怓慺傗怗攠偲偟偰懡條偵梡偄傜傟傞丅
丂丂丒丂俤俢俿俙乮僄僠儗儞僕傾儈儞巐恷巁乯偵傛傞僉儗乕僩揌掕丗
丂丂俤俢俿俙偼 巐墫婎巁偱偁傝丄俫4倄 偲昞偡丅乮捠忢偼丄俀俶倎墫偲偟偰梡偄傜傟傞乯丂俤俢俿俙偺巁夝棧暯峵偼丄
丂丂丂丂丂俫4倄丂亖丂俫亄丂亄丂俫3倄亅丂丄丂丂俲倎1丂亖丂侾丏侽亊侾侽亅2
丂丂丂丂丂俫3倄亅丂亖丂俫亄丂亄丂俫2倄2亅丂丄丂丂俲倎2丂亖丂俀丏俀亊侾侽亅3
丂丂丂丂丂俫2倄2亅丂亖丂俫亄丂亄丂俫倄3亅丂丄丂丂俲倎3丂亖丂俇丏俋亊侾侽亅7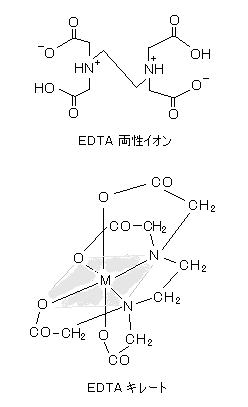
丂丂丂丂丂俫倄3亅丂亖丂俫亄丂亄丂倄4亅丂丄丂丂俲倎4丂亖丂俆丏俆亊侾侽亅11
丂丂俤俢俿俙偺慡擹搙 俠 偲偟偰丄倄4亅 偺暘棪 兛4 偼丄
丂丂丂丂俠/乵倄4亅乶丂亖丂侾/兛4丂亖丂乵俫亄乶4/乮俲倎1丒俲倎2丒俲倎3丒俲倎4乯 亄 乵俫亄乶3/乮俲倎2丒俲倎3丒俲倎4乯 亄 乵俫亄乶2/乮俲倎3丒俲倎4乯 亄 乵俫亄乶/俲倎4 亄 侾
偱偁傝丄暘棪 兛4 偼 慡擹搙 俠 偵埶懚偣偢丄乵俫亄乶乮亖倫俫乯偺傒偺娭悢偲側傞丅
丂丂嬥懏僀僆儞 俵2亄 偲 俤俢俿俙 偺惗惉掕悢偼丄
丂丂丂丂丂俵2亄丂亄丂倄4亅丂亖丂俵倄2亅丂丄丂丂俲倖丂亖丂乵俵倄2亅乶/乮乵俵2亄乶丒乵倄4亅乶乯丂丂偱昞偝傟傞偑丄寁嶼偑傗偭偐偄側乵倄4亅乶偺戙傢傝偵 暘棪 兛4 傪梡偄偰丄乵倄4亅乶 亖 兛4丒俠 傪戙擖偡傞偲丄
丂丂丂丂丂丂丂丂丂丂丂丂丂丂俲倖乫丂佭丂兛4丒俲倖丂亖丂乵俵倄2亅乶/乮乵俵2亄乶丒俠乯
丂丂偙偺 俲倖乫 乮忦審晅偒惗惉掕悢乯偼丄暘棪 兛4 偡側傢偪 倫俫 偵埶懚偡傞偺偱丄強掕偺 倫俫 偵偍偗傞 俲倖乫
偺抣偑暘偐傟偽丄揌掕偡傞 俵2亄 偺巆検傗擹搙乮倫俵亖亅倢倧倗乵俵2亄乶乯傪抦傞偙偲偑偱偒傞丅
丂丂掕検揑側揌掕傪偡傞偨傔偵偼丄 乵俵倄乮4亅値乯亅乶/乵俵値亄乶 亜 侾侽3丂偼昁梫偱偁傝丄偦偺偨傔偵偼丄倢倧倗 俲倖乫 亜 俉丂偲側傞 倫俫 偺斖埻偵梟塼傪挷惍偡傞昁梫偑偁傝丄奺庬偺倫俫娚徴塼傪梟塼偵揧壛偟偰梡偄傞丅乮俲倖乫丗丂僌儔僼嶲徠丂伀乯
丂丂僌儔僼傛傝丄偨偲偊偽丄 倫俫亖俀 偱偼丄俠倎2亄 偼俤俢俿俙偲傎偲傫偳僉儗乕僩傪惗惉偟側偄偺偱丄俠倎2亄偑嫟懚偟偰傕 俥倕3亄 偺傒傪掕検揑偵揌掕偱偒傞丅 倫俫亖俈 偱偼丄俵倗2亄 傪桳岠悢帤係寘偱揌掕偡傞偵偼揔摉偱偼側偔丄倫俫亖侾侽 偑昁梫丅傑偨丄倫俫亖俈
偱偺 俵 倗偺揌掕嬋慄偼摉検揰偱 倫俵倗 偺僕儍儞僾偑彫偝偄偺偱廔揰傪専弌偱偒側偄偑丄倫俫亖侾侽偱偼専弌偱偒傞丅
丂丂丂丂丂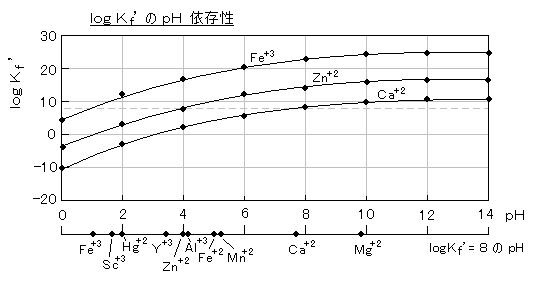
丂丂乮俀乯丂垷墧昗弨塼偵傛傞 俤俢俿俙亅俀俶倎 偺昗掕丗
丂丂嶌惢偟偨栺侽丏侽侾俵偺俤俢俿俙亅俀俶倎悈梟塼偺椡壙傪昗掕偡傞偨傔偵丄侾侽侽侽倫倫倣垷墧昗弨塼乮巗斕乯侾侽倣倢乮亖倅値丗
侾侽倣倗乯傪揌掕偡傞丅
丂丂乮侽丏侽侾俵 俤俢俿俙 侾倣倢丂亖丂侽丏侽侾亊尨巕検 倣倗丂亖丂侽丏俇俆俁俈倣倗
倅値乯
丂丂儂乕儖僺儁僢僩偱侾侽倣倢傪惓妋偵検傝庢傝丄扙僀僆儞悈偱栺俆侽倣倢偵婓庍偟丄倫俫侾侽娚徴塼乮俶俫3乮俀俉亾乯俆俈倣倢 亄 俶俫4俠倢 俈倗 /侾侽侽倣倢乯傪 栺侽丏俆倣倢壛偊偰 倫俫亖俈乣侾侽偲偟丄巜帵栻偲偟偰 俠倳亅俹俙俶乮及瞻蔬輥A摵俹俙俶丗 侾倗/俆侽亾 俬俹俙侾侽侽倣倢乯傪俁揌壛偊偰丄栺侽丏侽侾俵
俤俢俿俙亅俀俶倎 偱揌掕偡傞丅乮廔揰偺怓偼丄愒巼 仺 墿乯
丂丂揌掕偺寢壥丄俤俢俿俙 侾俆丏係俀倣倢傪梫偟丄侽丏侽侾俵偲偟偨寁嶼抣 侾侽丏侽侽/侽丏俇俆俁俈亖侾俆丏俁侽倣倢
偲斾妑偟偰丄侽丏侽侾俵 俤俢俿俙 亖 侽丏侽侽俋俋俀俀俵 偲昗掕偝傟偨丅
丂丂丂丂丂
丂丂乮俁乯丂儈僱儔儖僂僅乕僞乕拞偺 俠倎丄俵倗 偺揌掕丗
丂丂帋椏偺儈僱儔儖僂僅乕僞乕乮乭扟愳楢曯偺揤慠悈乭丄儔儀儖偵偼 峝搙亖俀係倣倗/倢偲昞帵乯偵娷傑傟傞 儅僌僱僔僂儉 偍傛傃 僇儖僔僂儉傪揌掕偡傞丅
丂丂乮侽丏侽侾俵 俤俢俿俙 侾倣倢丂亖丂侽丏俀係俁侾倣倗 俵倗丂亖丂侽丏係侽侽俉倣倗
俠倎乯
丂丂侾乯丂俵倗 亄 俠倎丗丂帋椏悈 侾侽侽丏侽倣倢傪儊僗僔儕儞僟乕偱検傝庢傝 俁侽侽倣倢僐僯僇儖價乕僇乕偵擖傟丄忋婰偺倫俫侾侽娚徴塼 栺俁倣倢傪壛偊偰 倫俫亖侾侽 慜屻偲偟丄巜帵栻偲偟偰 俛俿乮俤俛俿丄僄儕僆僋儘儉丒僽儔僢僋 俿丄侽丏侽俆倗/侾侽侽倣倢儊僞僲乕儖梟塼乯悢揌傪壛偊丄忋婰偺
侽丏侽侾俵乮侽丏侽侽俋俋俀俀俵乯俤俢俿俙偱揌掕偡傞丅乮愒 仺 惵乯
丂丂寢壥偼丄俤俢俿俙偺強梫検 俀丏俇侽倣倢偱丄丂乵俵倗2亄乶 亄 乵俠倎2亄乶 亖 乮侽丏侽侽俋俋俀俀亊俀丏俇侽倣倢乯/侾侽侽倣倢 亖 侽丏俀俁俋俀亊侾侽亅3俵 偩偭偨丅
丂丂亪丂峝搙乮乵俵倗2亄乶 亄 乵俠倎2亄乶 傪 俠倎俠俷3乮暘巕検亖侾侽侽丏侾乯 偵姺嶼偟偨抣乮倣倗/倢乯乯偼丄丂侽丏俀俁俋俀亊侾侽亅3俵 亊 侾侽侽丏侾亊侾侽3 亖 俀俁丏俋乮倣倗/倢乯 偱偁傝丄儔儀儖偺昞帵抣偲傎傏堦抳偟偨丅
丂丂俀乯 俠倎 偺傒丗丂帋椏悈 侾侽侽丏侽倣倢傪儊僗僔儕儞僟乕偱検傝庢傝丄俉俵 俲俷俫悈梟塼 俇倣倢傪壛偊 倫俫亖侾俀乣侾俁 偲偟丄偟偽傜偔潣漚偟偰俵倗乮俷俫乯2傪廩暘捑揳偝偣傞丅乮捑揳偡傞偲梟塼偺宯奜偲側傝
俤俢俿俙偲斀墳偟側偔側傞乯丂巜帵栻偲偟偰 俶俶婓庍暡枛乮俶俶巜帵栻傪俲2俽俷4偲侾丗侾侽侽埵偱崿偤偰 嫟偵暡枛偵偟偨傕偺乯傪栺侽丏侽侾倗乮帹偐偒侾攖掱搙乯壛偊偰揌掕偡傞丅乮愒 仺 惵乯
丂丂寢壥偼丄俤俢俿俙偺強梫検 侾丏俈侾倣倢偱丄丂乵俠倎2亄乶 亖 乮侽丏侽侽俋俋俀俀亊侾丏俈侾倣倢乯/侾侽侽倣倢 亖 侽丏侾俇俋俈亊侾侽亅3俵 偲側偭偨丅
丂丂偟偨偑偭偰丄丂乵俵倗2亄乶 亖 侽丏俀俁俋俀亊侾侽亅3 亅 侽丏侾俇俋俈亊侾侽亅3 亖 侽丏侽俇俋俆亊侾侽亅3俵 丅
丂丂仏丂場傒偵丄搶嫗搒峕屗愳嬫偺悈摴悈傕挷傋傞偲丄偙偺儈僱儔儖僂僅乕僞乕傛傝傕峝搙偑崅偔丄俇俉丏侽倣倗/倢偩偭偨丅
巗斕偺儈僱儔儖僂僅乕僞乕偺峝搙偼奺抧偺嵎偑戝偒偔 係乣侾係侽 偔傜偄偲偄傢傟傞丅
丂丂乮 拲乯丂俠倎丄俵倗偺擹搙偑崅偄応崌 俵倗偺捑揳偺帪 俠倎偑嫟捑偟偰戝暆偵嫸偆偺偱丄廩暘婓庍偟偰揌掕偡傞丅
揝暘側偳偑懡偄偲偒偼儅僗僉儞僌嵻偲偟偰僩儕僄僞僲乕儖傾儈儞丄俲俠俶側偳傪壛偊傞丅乯

丂丂乮係乯丂僷乕儅儘僀傔偭偒塼拞偺 俶倝 偺揌掕丗
丂丂僷乕儅儘僀傔偭偒塼乮 俶倝俽俷4丒俇俫2俷 俆俇丏俀倗丄俶倝俠倢2丒俇俫2俷
侾丏俆倗丄俥倕俽俷4丒俈俫2俷 俀丏係倗丄俫3俛俷3 俈丏俆倗丄僒僢僇儕儞俶倎丒俀俫2俷
侽丏俋倗 傪忋嶮揤攭偱検傝庢傝丄扙僀僆儞悈偵梟偐偟偰 俁侽侽倣倢偵偟偨塼乯拞偺
俶倝 傪揌掕偡傞丅
丂丂乮侽丏侽侾俵 俤俢俿俙 侾倣倢丂亖丂侽丏俆俉俈侾倣倗 俶倝乯
丂丂傔偭偒塼傪侾侽侽攞偵婓庍偟偰 偦偺侾侽倣倢傪庢傝 悈傪壛偊偰栺俆侽倣倢偵偟丄倫俫侾侽娚徴塼侾丏俆倣倢傪壛偊偰倫俫亖俈乣侾俀偲偟丄娷傑傟偰偄傞 俥倕 偺儅僗僋嵻偲偟偰 侾俆亾僩儕僄僞僲乕儖傾儈儞 侽丏俆倣倢傪揧壛偟丄俵倃婓庍暡枛乮儉儗僉僔僪乯傪巜帵栻偲偟偰揌掕偡傞丅乮墿 仺 愒巼乯
丂丂寢壥偼丄侽丏侽侾俵 俤俢俿俙 俈丏俁俇倣倢傪梫偟丄寁嶼抣 係丏俁侽係倣倗 偵懳偟丄俈丏俁俇亊侽丏俆俉俈侾亊侽丏俋俋俀俀亖 係丏俀俉俈倣倗 偱偁傝丄傗傗敄傔偩偭偨丅
丂丂堦曽丄俥倕 乮侽丏侽侾俵 俤俢俿俙 侾倣倢丂亖丂侽丏俆俆俉俆倣倗 俥倕乯偼丄侾侽攞偵敄傔偨塼偐傜侾侽倣倢庢偭偰俆侽倣倢偲偟丄侾侽亾俫2俷2 侾倣倢偱巁壔偟偰
偡傋偰 俥倕乮嘨乯偲偟偰偐傜俆乣侾侽暘幭暒偟俫2俷2傪姰慡偵暘夝偟丄悈傪壛偊偰俆侽倣倢偵偡傞偲丄悈巁壔揝乮嘨乯偑捑揳偡傞丅懡検偵嫟懚偡傞俶倝傪旔偗傞偨傔偵
捑揳傪鄅夁偟偰 俥倕偺傒偲偟丄侾丗侾墫巁偱梟弌偟悈偱廩暘愻偄弌偡丅俆侽倣倢偵偟偰偐傜丄倫俫傪應掕偟側偑傜侾侽亾俶俫3偲
俀侽亾恷巁俁倣倢 乮偲 侾丗侾 俫俠倢乯 偱 倫俫亖侾丏俈乣俁 偲偡傞丅丂巜帵栻偼丄倁俛俛婓庍暡枛乮僶儕傾儈儞僽儖乕乯乮惵巼 仺 柍怓乯丄偁傞偄偼丄倫俫亖俀乣俁偱 僒儕僠儖巁乮愒巼 仺 敄偄墿乯傪梡偄偰傕椙偄丅 俤俢俿俙 亖 俀丏俋侽倣倢偱丄俥倕丗 侾丏俇侾倣倗丅
丂
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂栠傞丂丂丂丂丂丂丂丂丂丂丂僩僢僾傊栠傞

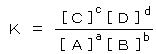 丂偱梌偊傜傟傞丅乮乵丂乶偼儌儖擹搙乮倣倧倢/倢乯乯丂儌儖暯峵掕悢偑戝偒偄傎偳丄斀墳偑塃偵恑傓丅
丂偱梌偊傜傟傞丅乮乵丂乶偼儌儖擹搙乮倣倧倢/倢乯乯丂儌儖暯峵掕悢偑戝偒偄傎偳丄斀墳偑塃偵恑傓丅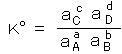 丂丂偱昞偝傟傞丅丂偙傟偼丄僊僽僘偺昗弨惗惉帺桼僄僱儖僊乕嚈俧倧 偲丄丂
丂丂偱昞偝傟傞丅丂偙傟偼丄僊僽僘偺昗弨惗惉帺桼僄僱儖僊乕嚈俧倧 偲丄丂



 偱偼側偄峝偄巁偲峝偄墫婎偳偍偟偑寢崌偟傗偡偄丅
偱偼側偄峝偄巁偲峝偄墫婎偳偍偟偑寢崌偟傗偡偄丅



